Блокировка рецептора помогла мышам восстановиться после инсульта
Исследователи ищ США рассказали о разработке нового метода лечения после инсультаю Речь идет о блокировке рецептора PTP-sigma, которая способствовует прорастанию новых нейронных отростков и генерации нейробласт. Эксперименты на мышах показали, что такая терапия помогла им восстановить локомоторные, сенсомоторные и когнитивные функции.
Инсульт — острое нарушение кровоснабжения головного мозга — вторая по распространенности причина смертности в России. Последствия инсульта включают в себя неврологическую симптоматику (двигательные, зрительные и речевые нарушения), а если пациенту не будет оказана соответствующая помощь, он может привести к летальному исходу в следствие патологии сосудов головного мозга. На данный момент врачи используют реперфузию (улучшение кровоснабжения) и нейропротекторные средства (которые защищают нервные клетки от повреждения) как основную терапию, имеющую узкие временные рамки. Для этого недавно группа китайских исследователей разработала белок Tat-CIRP, который показал на мышах свою эффективность в снижении объема поражения и неврологического дефицита при инсульте. Однако потенциал для регенерации после инсульта намного дольше, например, нейрогенез и прорастание аксонов можно также использовать в восстановительных целях.
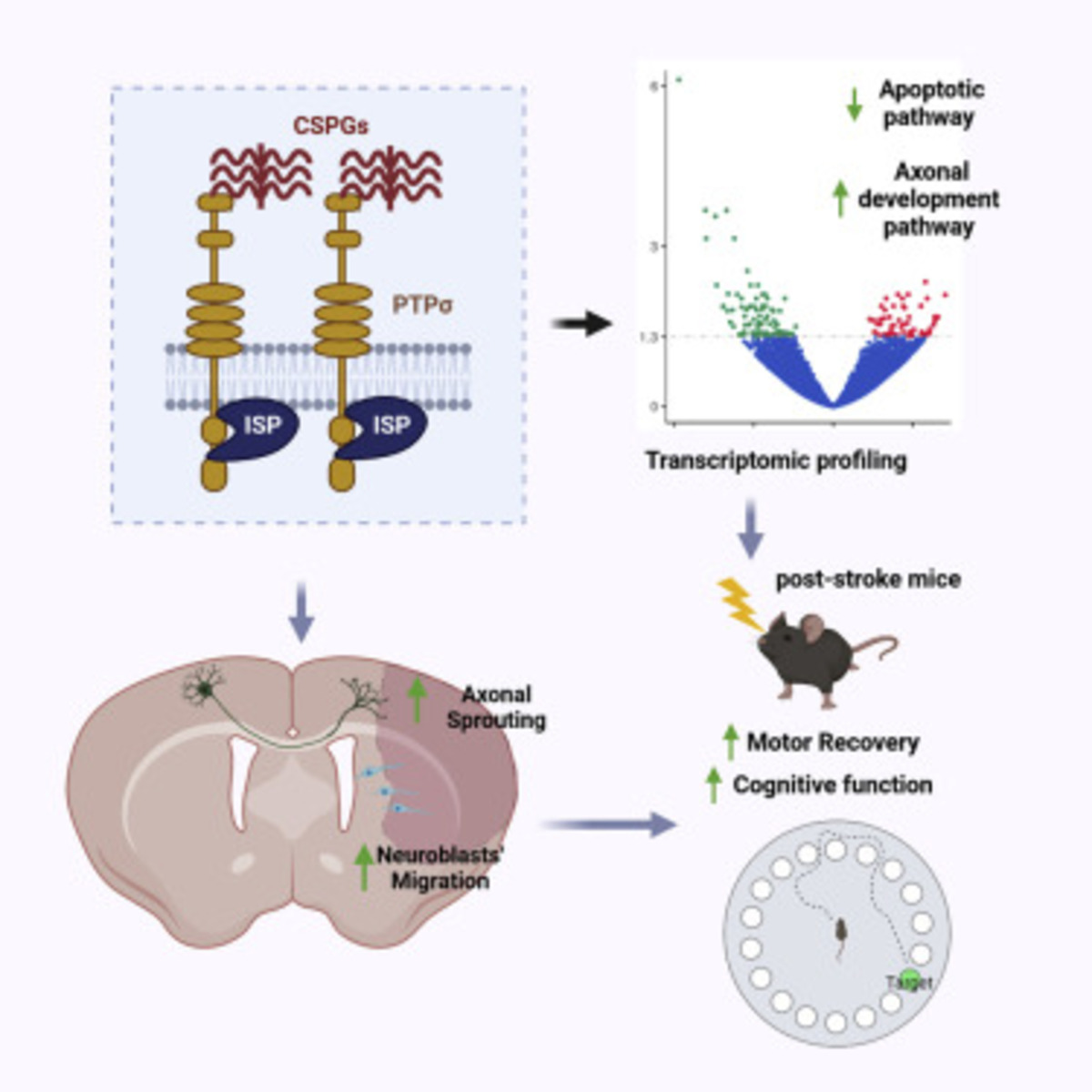
Хондроитинсцльфат протеогликаны (ХСПГ) играют важную роль в регенерации центральной нервной системы после травм, в результате которых астроциты выделяют в большом количестве белки-ХСПГ, создавая на этом месте глиальный рубец. Экспериментальные модели показали, что регенерирующие аксоны не способны прорастать через такой рубец, что может мешать восстановлению после инсульта. Рецепторная белковая тирозиновая фосфатаза сигма (PTP-sigma) является основным рецептором ХСПГ, а блокировка их взаимодействия, согласно прошлым исследованиям на животных, содействует регенерации поврежденных нервов и улучшает их функции.
Исследователи из США под руководством Фученга Луо (Fucheng Luo) проверили гипотезу о препарате на основе пептида, который блокирует взаимодействие ХСПГ и PTP-sigma, что способствует нейрорегенерации после инсульта. Для этого они сначала провели несколько тестов в пробирке, а затем изучили на мышах после инсульта терапевтическое действие внутриклеточного сигма-пептида (ISP) — разработанного ранее пептида, который связывается с PTP-sigma и блокирует его работу.
Схема ингибирования ХСПГ-рецептора
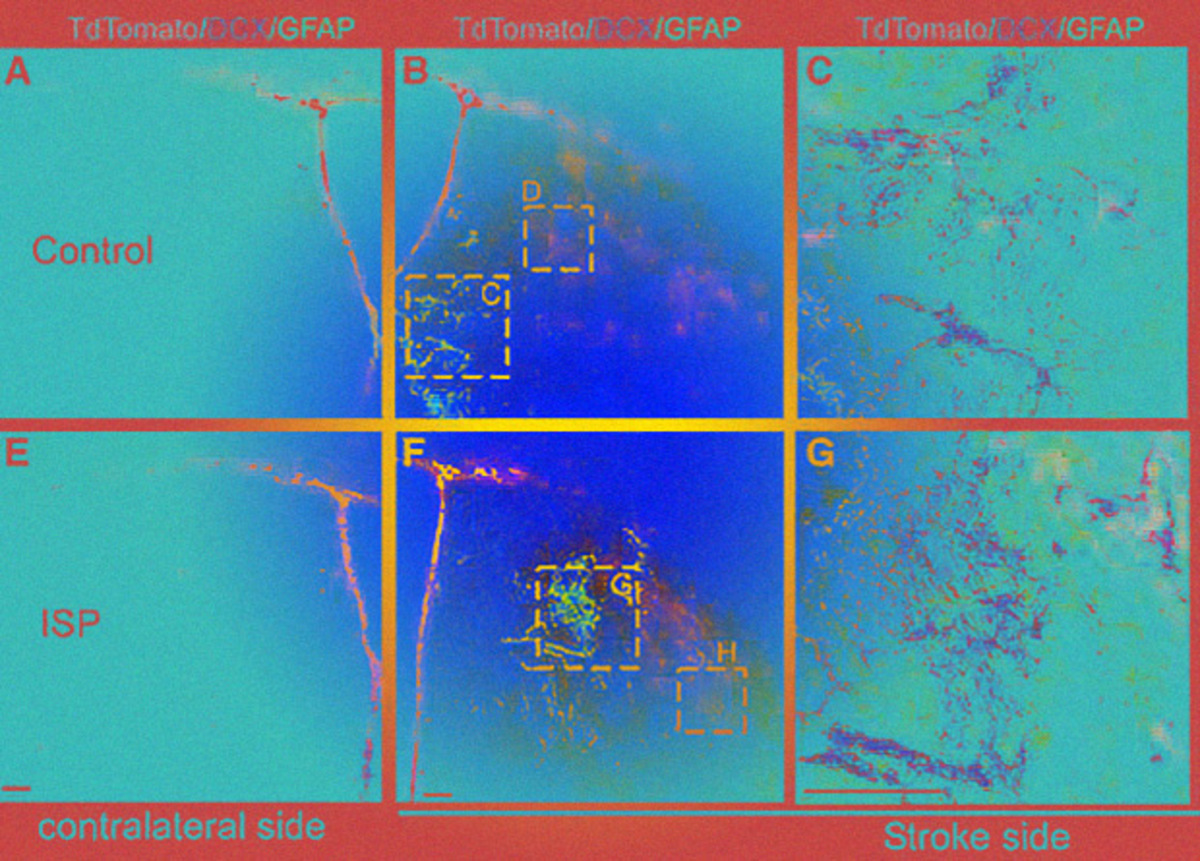
На первом этапе на модели поражения после инсульта с помощью процедуры окрашивания исследователи убедились, что после ишемического инсульта ХСПГ содержатся в глиальном рубце в избытке по равнению с обычными тканями. Тем же способом они сравнили выработку ХСПГ в культивированной нейросфере из субвентрикулярной зоны, которая является источником новых нейронов (нейрогенеза) у взрослых, и в субвентрикулярной зоне живых мышей. В обоих случаях ХСПГ содержался в избытке, что говорит о том, что они могут участвовать в регуляции стволовых клеток у взрослых. Затем исследователи выделили стволовые клетки и дали им дифференцироваться в течение пяти дней под воздействием ISP, в результате чего они отметили повышенный процесс развития нейронных отростков (похожий эффект достигался и при удалении гена ХСПГ).
Далее на двух группах мышей исследователи проверили эффективность лечения пептидом с первого дня после инсульта: экспериментальная группа мышей получала ISP в течение 30 дней, а контрольная группа — рандомизированный ISP, состоящий из тех же аминокислот, но в случайном порядке. В первой группе исследователи обнаружили повышенный уровень даблкортина, который ассоциируют с микротрубочками, создаваемыми клетками-предшественниками в процессе развития в нейроны. Также был увеличен и уровень миграции даблкортина в полутень — ткани, которые находятся в зоне риска и зависят от восстановления кровотока. У контрольной группы мышей изменений не было.
Авторы также проверили гипотезу о том, что лечение ISP способствует прорастанию аксонов на мышах, получивших лечение в первый день или через семь дней после инсульта. Экспериментальные мыши отличались повышенным количеством проекций аксонов в зоне полутени, а также сниженной атрофией, которую оценивали на 30 день после инсульта. При этом, у мышей, терапия которых началась с первого дня после инсульта, поражение оказалось меньше.
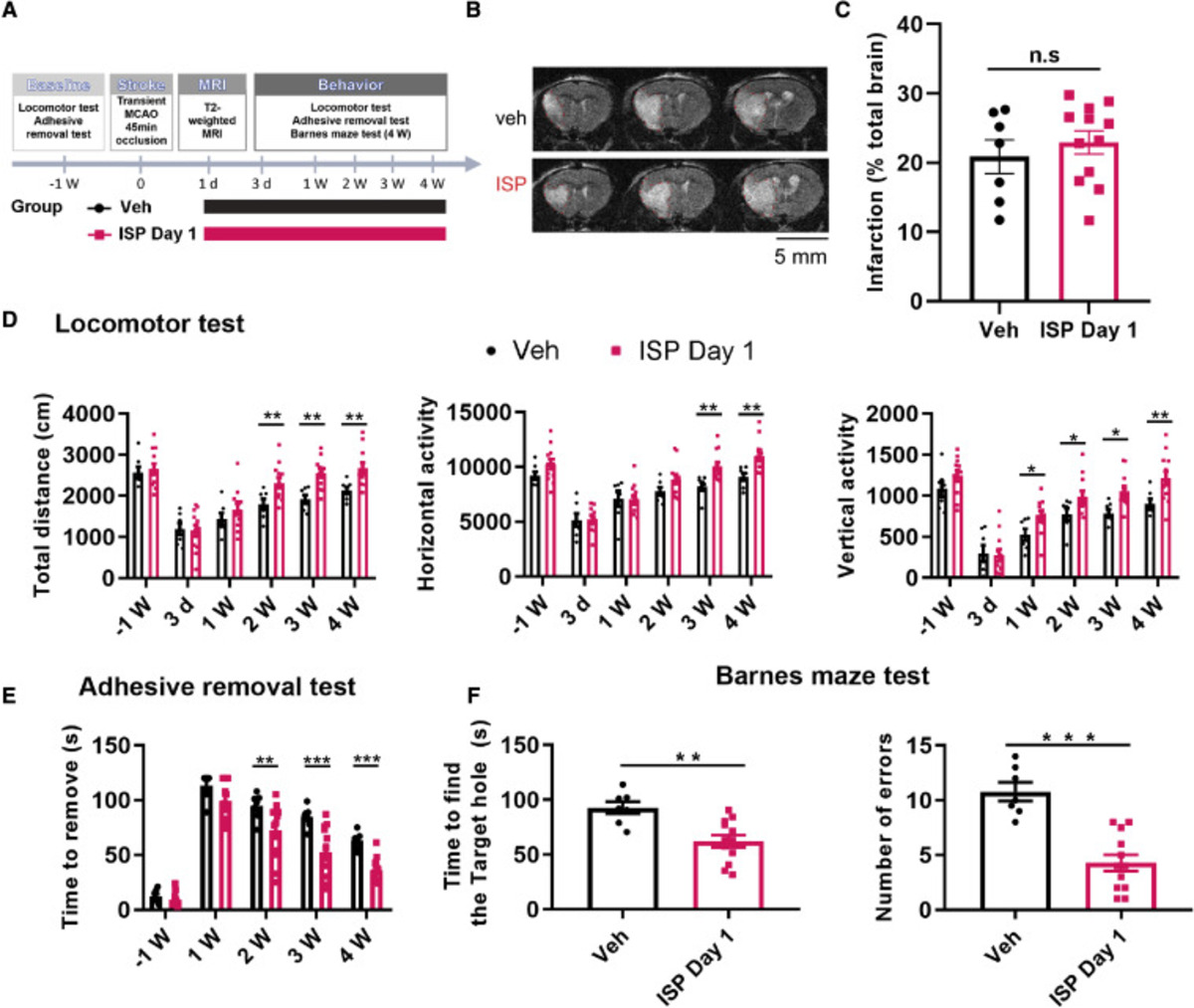
На последнем этапе исследователи провели три поведенческих тестирования. Монитор активности мышей выявил улучшение локомоторной функции (перемещение в пространстве) у экспериментальной группы (p < 0,01), а тест на удаление клейкой ленты показал, что лечение ISP помогло мышам быстрее удалять ленту с больной лапы (p < 0,001). С помощью лабиринта Барнса авторы оценили когнитивные функции мышей и обнаружили, что мыши, прошедшие терапию, значительно быстрее (p < 0,01) и с меньшим количеством ошибок (p < 0,001) находили выход из лабиринта. Сдвиг начала терапии незначительно влиял на восстановление локомоторных, сенсомоторных и когнитивных функций.
Экспериментальный план (A), МРТ-снимки (B) и результаты поведенческих тестов (D-F)
Таким образом, авторы показали, что, во-первых, фармакологическая и генетическая ингибиция рецептора PTP-sigma ведет к повышенному развитию нейронных отростков у стволовых клеток и снижению атрофии по сравнению с контрольной группой мышей. Во-вторых, что такое лечение помогает в восстановлении локомоторных, сенсомоторных и когнитивных функций.


Мы уже видели как амы 16 лет лечили болезнь Альцгеймера